名古屋大学 大学院工学研究科 機械システム工学専攻/機械・航空宇宙工学科 バイオメカニクス研究室へようこそ!
細胞のバイオメカニクスに関する研究
細胞の力学特性・発生張力計測に関する研究
1)血管平滑筋細胞の力学特性に対する細胞骨格の影響
研究の背景
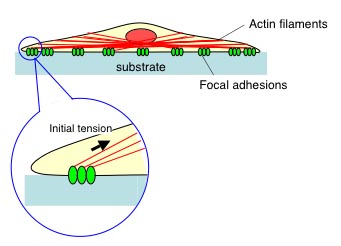
平滑筋細胞は血管壁内に存在する細胞で,この細胞が収縮,弛緩することによって血管径の調節が行われています.さらにこの細胞は,血管壁内の力学環境の変化に応じて自らの構造を適応させるという興味深い特性を持っています.このような平滑筋細胞の収縮メカニズムや,力学的適応のメカニズムを解明するためには,一つ一つの細胞の力学的特性を明らかにすることが不可欠です.ところで,細胞内にはアクチンフィラメント,微小管,中間径フィラメントという線維状のタンパク質が存在し,これらは「細胞骨格」と呼ばれています(図1?1). 細胞骨格は,細胞が分裂するとき,また引張り,圧縮などの力学的刺激に曝されたときに再構築を見せることが確認されています.本研究は,これらのそれぞれの細胞骨格が平滑筋細胞の力学的特性にどのような影響を与えているのか解明することを目的としています.
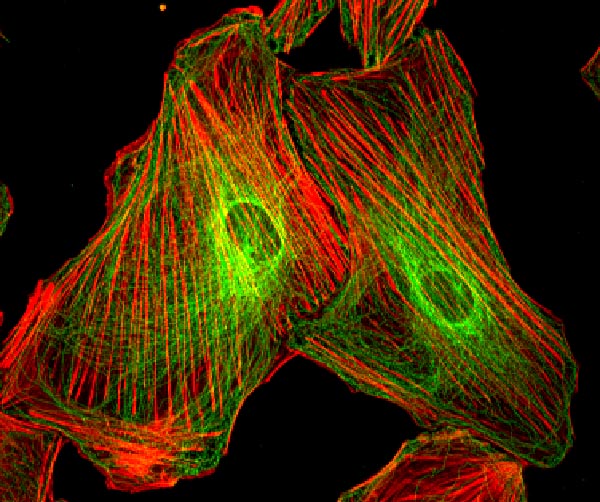
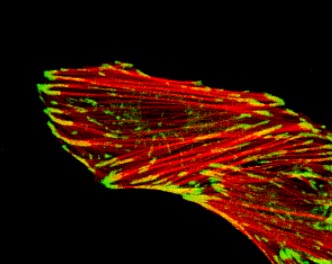
図1-1.培養平滑筋細胞内のアクチンフィラメント (赤) と微小管 (緑)
研究内容
私たちの研究室では2本のマイクロピペットを用いて一つの細胞を把持し,顕微鏡下で引張試験を行うことができる「細胞用マイクロ引張試験装置」を開発しました(図1?2).この装置を利用して,血管壁から単離した直後の平滑筋細胞や培養細胞の弾性特性や粘弾性特性を調べて詳細に調べています.細胞骨格は化学処理によって破壊することができるので,アクチンフィラメントや微小管などを破壊した状態で引張試験を実施することによって,それぞれの細胞骨格が細胞全体の力学的特性に与える影響を調べることができます,
これまでに,血管から摘出した直後の平滑筋細胞や,長期間人工的に培養した細胞の引張特性を計測したところ,培養細胞の硬さ (弾性率) は血管から摘出した直後の細胞に比べ1/3~1/4程度であることが分かりました.また,アクチンフィラメントの線維構造を破壊することによって,さらに半分程度まで硬さが低下することなどが分かっています (図1?3).このように,平滑筋細胞全体の力学特性にはアクチンフィラメントの量,構造,細胞内での分布様態が大きく関与すると考えられます.また,当研究室では,平滑筋細胞がアクチンフィラメントの走向方向に依存した力学的な異方性を有することを世界で初めて示しました.
さらに,最近では,細胞骨格が細胞の力学特性だけでなく,細胞の高さにも影響を与え,細胞内の力のバランスを保つために重要な働きをしていることも明らかとなってきました (図1?4) .
これまでに,血管から摘出した直後の平滑筋細胞や,長期間人工的に培養した細胞の引張特性を計測したところ,培養細胞の硬さ (弾性率) は血管から摘出した直後の細胞に比べ1/3~1/4程度であることが分かりました.また,アクチンフィラメントの線維構造を破壊することによって,さらに半分程度まで硬さが低下することなどが分かっています (図1?3).このように,平滑筋細胞全体の力学特性にはアクチンフィラメントの量,構造,細胞内での分布様態が大きく関与すると考えられます.また,当研究室では,平滑筋細胞がアクチンフィラメントの走向方向に依存した力学的な異方性を有することを世界で初めて示しました.
さらに,最近では,細胞骨格が細胞の力学特性だけでなく,細胞の高さにも影響を与え,細胞内の力のバランスを保つために重要な働きをしていることも明らかとなってきました (図1?4) .
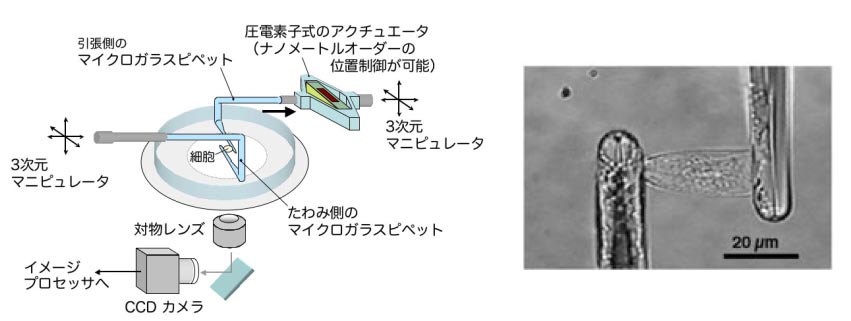
図1-2.細胞用マイクロ引張試験装置(左)と引張試験の様子(右)
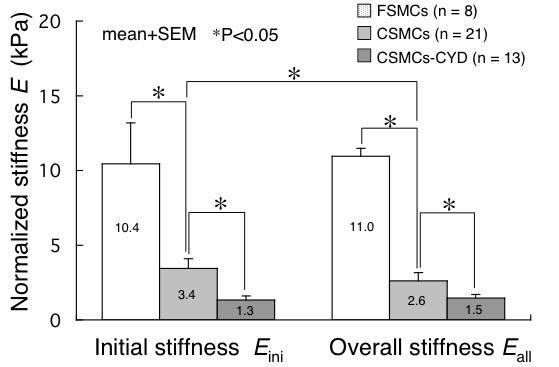
図1-3. 細血管平滑筋細胞の弾性率.FSMC,血管から単離直後の細胞; CSMCs,培養した細胞;
CSMCs-CYD,アクチンフィラメントを破壊した培養細胞).(Nagayama et al, J Biomech, 2006).
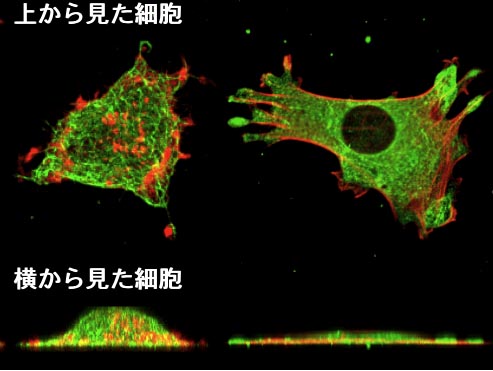
図1-4. 血管平滑筋細胞内のアクチンフィラメント(赤)と微小管(緑).
アクチンフィラメントを破壊した場合(左)は細胞の高さが増加し, 微小管のみを破壊した場合(右)は高さが減少する.(Nagayama and Matsumoto, Am J Physiol, Cell Physiol, 2008)
2)血管平滑筋細胞の応力緩和特性の計測
研究の背景
細胞は粘性を有するため,その粘弾性特性を明らかにすることが重要です.しかし,細胞の力学特性計測に関する従来の多くの研究では,トリプシン処理などで基板から剥離した球形の細胞を用いており,生理状態の細胞形状と大きく異なるという問題があります.そこで本研究では,培養血管平滑筋細胞を対象とし,細胞用マイクロ引張試験装置を用い,基板上での形状を維持したまま細胞を基板から剥離して張力緩和試験を行いました.また,細胞外Ca2+の有無が細胞の粘弾性特性に与える影響も検討しました.
研究内容
試料はラット胸大動脈から酵素法により単離して長期間培養した平滑筋細胞を用いました.ガラスボトムディッシュ上で培養した細胞の培地をCa2+とMg2+を含まないハンクス平衡緩衝塩液に交換して静置し,細胞の基板付着力を低下させます.そして,2 本のマイクロピペットを表面に軽く押し付けて細胞を把持し,細胞を基板から徐々に持ち上げることで,付着形状を維持しつつ細胞を基板から剥離します(図2?1左).次に細胞を一定速度で目標ひずみ30% まで引張った後,ひずみを一定に保ちながら,その後の張力変化を計測しました.溶液中のCa2+濃度を上げた状態で同様の試験も行いました.こうして細胞外Ca2+の有無の影響を調べました.
引張後,細胞の張力が指数関数的に緩和していく様子が計測されました(図2?1右).引張直後の張力はCa2+の有無によって差が見られませんでしたが,時間が経過すると共に差が生じ,Ca2+が無い場合の張力緩和率が大きくなることが分かりました.細胞は溶液中のCa2+により高い張力を維持できると考えられます.今後は,より生体内に近い細胞として,血管から単離した直後の細胞を用いて実験を進めていく予定です.
引張後,細胞の張力が指数関数的に緩和していく様子が計測されました(図2?1右).引張直後の張力はCa2+の有無によって差が見られませんでしたが,時間が経過すると共に差が生じ,Ca2+が無い場合の張力緩和率が大きくなることが分かりました.細胞は溶液中のCa2+により高い張力を維持できると考えられます.今後は,より生体内に近い細胞として,血管から単離した直後の細胞を用いて実験を進めていく予定です.
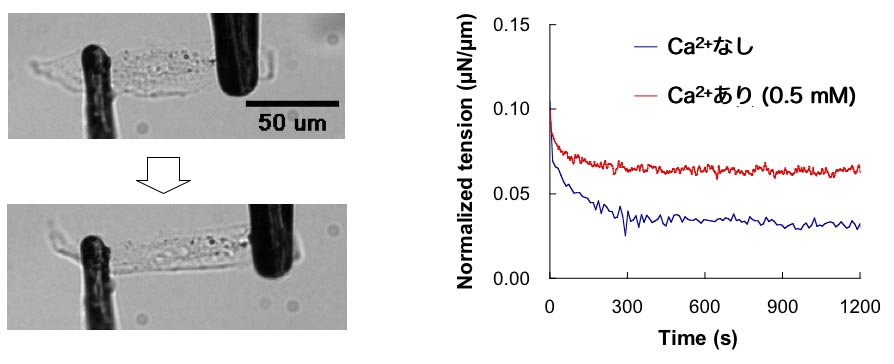
図2-1.細胞の張力緩和試験の様子(左)と,ひずみを30%に保持した状態での張力緩和の様子(右).
溶液中のC2+濃度が高い場合は張力が保持される.3)マイクロピラーを用いた細胞焦点接着部位での張力計測
研究の背景
細胞は生体内で絶えず形を変え,移動しています.例えば,擦り傷など負ったときは,欠損した部分を修復するために周りの細胞が欠損部分へと移動します.また,体内の細胞は日々分裂を繰返し作り変えられています.このように細胞が移動したり自分自身の形状を変化させるためには,細胞自身が発生する力が関係すると考えられています.
また最近では,細胞が焦点接着斑と呼ばれる接着タンパク質の集合部位で細胞外基質と点状に接着し (図3?1),この焦点接着班の一部が,細胞骨格の一つであるアクチンフィラメントに連結していることが明らかになっています.これらの焦点接着班が杭 (くい) の役割を果たし,細胞骨格がロープのように引張られた状態になることによって,ちょうどテントのようにして細胞全体の形態を維持しているのではないかと考えられています.
このように,細胞の移動や増殖,形態維持のメカニズムを知る上で,細胞が基質上で発生する力を知ることは極めて重要と言えます.
また最近では,細胞が焦点接着斑と呼ばれる接着タンパク質の集合部位で細胞外基質と点状に接着し (図3?1),この焦点接着班の一部が,細胞骨格の一つであるアクチンフィラメントに連結していることが明らかになっています.これらの焦点接着班が杭 (くい) の役割を果たし,細胞骨格がロープのように引張られた状態になることによって,ちょうどテントのようにして細胞全体の形態を維持しているのではないかと考えられています.
このように,細胞の移動や増殖,形態維持のメカニズムを知る上で,細胞が基質上で発生する力を知ることは極めて重要と言えます.
図3-1.基質上での細胞.細胞は焦点接着斑と呼ばれる点状の接着部位(緑)で基質に接着しており,この部分にアクチンフィラメント(赤)が連結している.
アクチンとミオシンによる力が焦点接着斑を介して基質に伝わると考えられている.研究内容
当研究室では,細胞の足場である焦点接着部位での力を正確に計測するマイクロデバイスの開発を進めています.現在は微細加工技術を利用して,直径と高さが数μm程のシリコーンゴム製の柱(マイクロピラー)が無数に並んだ基板を作製し,その上で細胞を培養する方法を用いています(図3?2).細胞の焦点接着斑に加わる力によってマイクロピラーがたわむので,ピラーのたわみ量とその方向を正確に計測してnNレベルの力ベクトルの変化を正確に計測して,細胞が動くときの力分布などを調べています.
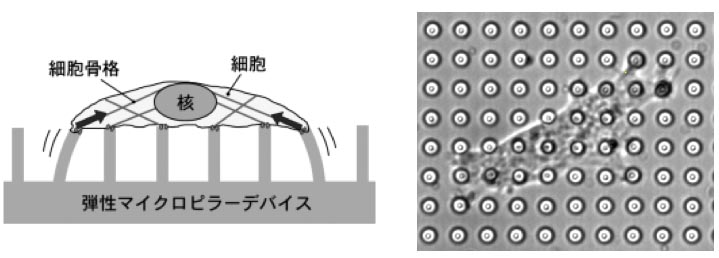
図3-2.マイクロピラーの概念図(左)と実際にピラー上に培養した細胞の様子(右).