名古屋大学 大学院工学研究科 機械システム工学専攻/機械・航空宇宙工学科 バイオメカニクス研究室へようこそ!
細胞のバイオメカニクスに関する研究
FRET型張力センサを用いた細胞内ひずみのマルチスケール解析
研究背景
細胞骨格のひとつであるストレスファイバ (SF) に生じる張力は細胞の力学応答に重要な役割を果たしていますが,その詳細についてはよくわかっていません.ところで近年,FRET現象 (図1) を利用した細胞内部の力を計測できる張力センサが注目されています.センサを利用した研究として,我々は細胞内の個々のSFを単離してガラスマイクロピペットで引張試験を行い,SFの伸びとFRET変化の関係を調べることでSF内部の張力分布を計測しました.しかし,生細胞内での実際のSFの微視的な変形や張力の計測に関する研究は我々の知る限りまだありません.本研究では,FRET型張力センサであるActinin-sstFRET-GR (GRセンサ) (図2) を用いて,細胞を段階的に引張った際のSF内のアクチニンの動態とFRETの変化から,生細胞内ひずみの不均質性を明らかにし,その原因を探ること,局所のひずみとアクチニンのFRET ratioとの相関を調べることを目的としました.
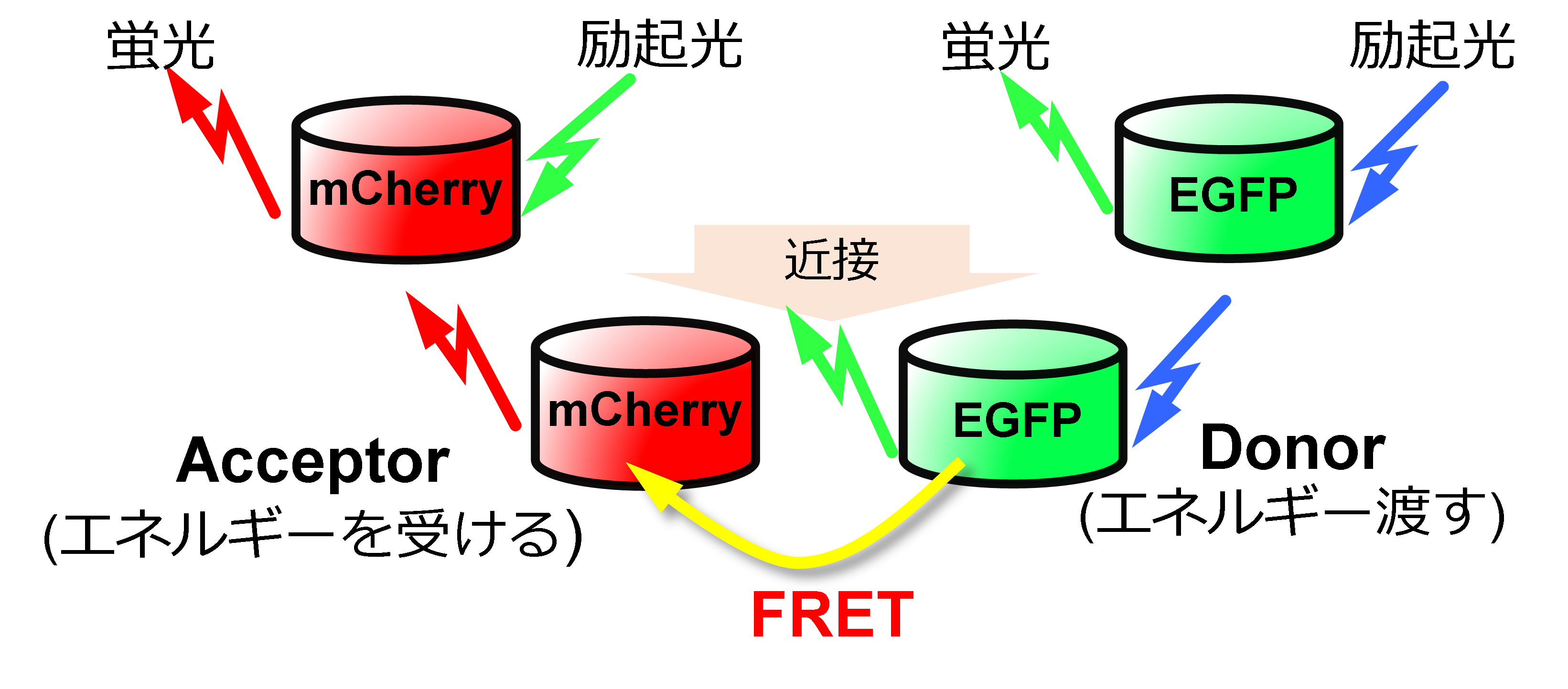
図1 FRET現象
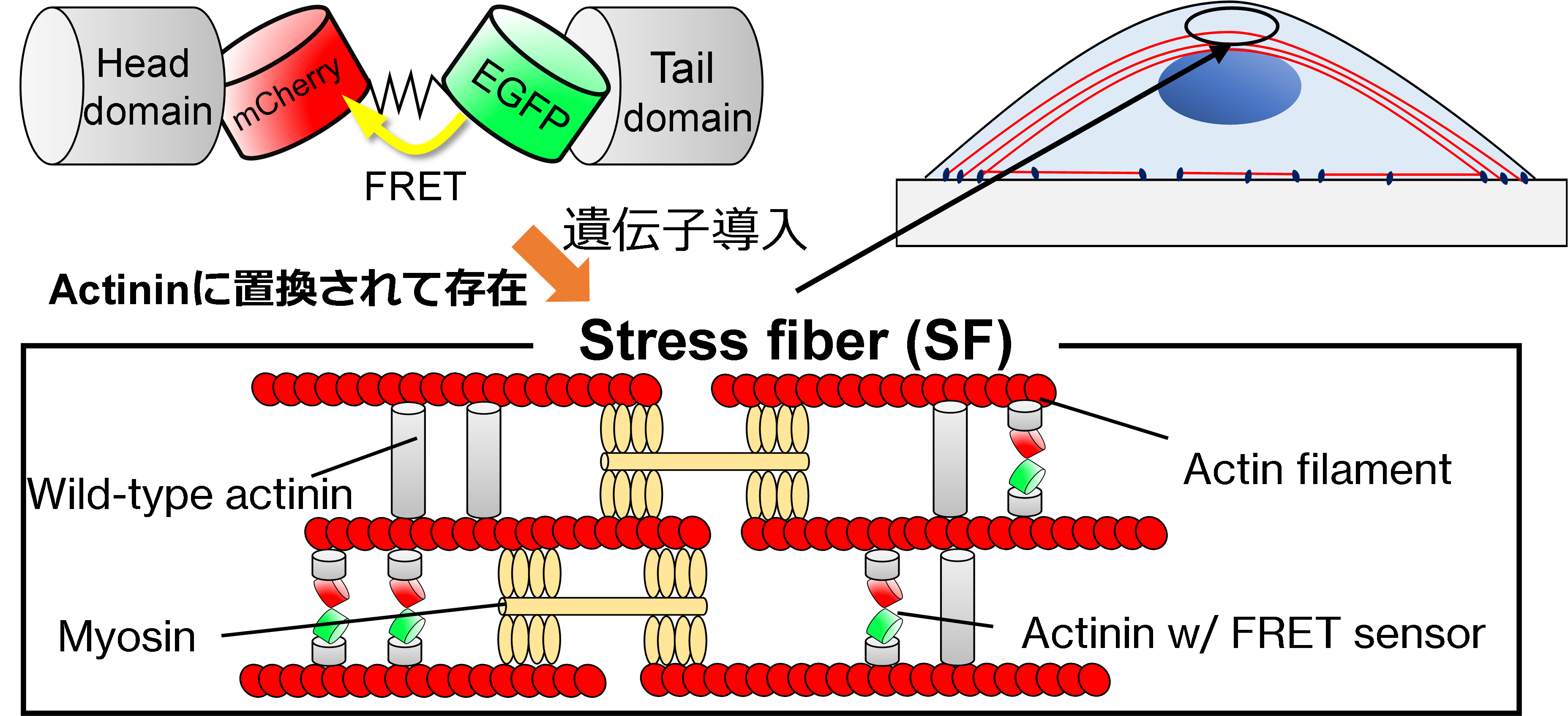
図2 Actinin-sstFRET-GR
細胞への引張負荷
シリコーン膜上に細胞を播種し,引張試験装置で膜ごと引張り,細胞に引張負荷を加えました.2段階で引張り,引張ごとに画像を撮影しました.得られた画像から引張試験による細胞変形について,シリコーン膜,細胞まるごと,SF丸ごと,SFの部分,アクチニン間距離とマルチスケールレベルでひずみを計測しました.さらにSF内の局所のひずみとアクチニンのFRET ratioとの相関を調べました.
図3に示す通り,外縁部SF全体ひずみは膜の変形 (理論値) とほぼ同じですが,GRセンサによって点在化したアクチニンを標点として用いてSFを区分けし,部分ひずみを調べたところ,ばらつきが大きいことがわかりました.また,内部のSFについてもばらつきが大きいことがわかりました.一方,ホルマリン固定して完全に不活性化した細胞に引張負荷を加えたところ,図4の通り,ばらつきが小さくなり不均質性が抑制されました.以上より,ひずみの不均質性はSF内のタンパク質の変化によるものである可能性が示唆されました.
図3に示す通り,外縁部SF全体ひずみは膜の変形 (理論値) とほぼ同じですが,GRセンサによって点在化したアクチニンを標点として用いてSFを区分けし,部分ひずみを調べたところ,ばらつきが大きいことがわかりました.また,内部のSFについてもばらつきが大きいことがわかりました.一方,ホルマリン固定して完全に不活性化した細胞に引張負荷を加えたところ,図4の通り,ばらつきが小さくなり不均質性が抑制されました.以上より,ひずみの不均質性はSF内のタンパク質の変化によるものである可能性が示唆されました.
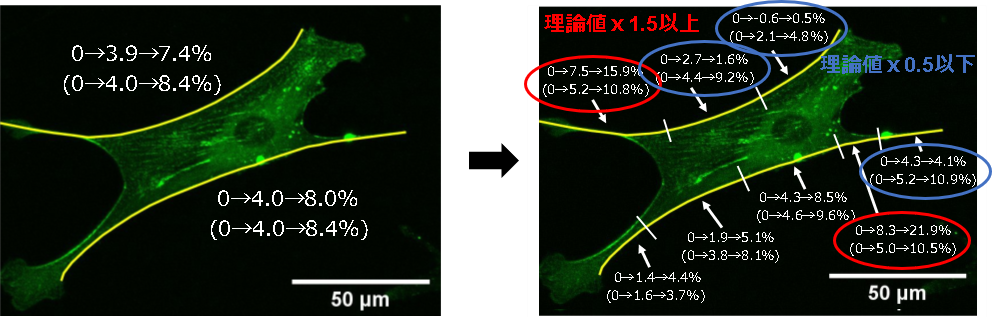
図3 正常細胞の外縁部SFひずみ(左)全体ひずみ(右)区分ひずみ

図4 ホルマリン固定細胞の外縁部SFひずみ
SF (図5 (左上) ) の個々のアクチニン間の距離変化を調べたところ,図5 (左下) に示す通り,単一SFのひずみよりも更にばらつきが大きいことがわかりました.また,同じ箇所のアクチニンのFRET ratioと局所ひずみ (Local SF strain at actinin i, εAi 図5(右上) ) の変化を調べたところ,相関が無いことがわかりました (図5 (右下) ).
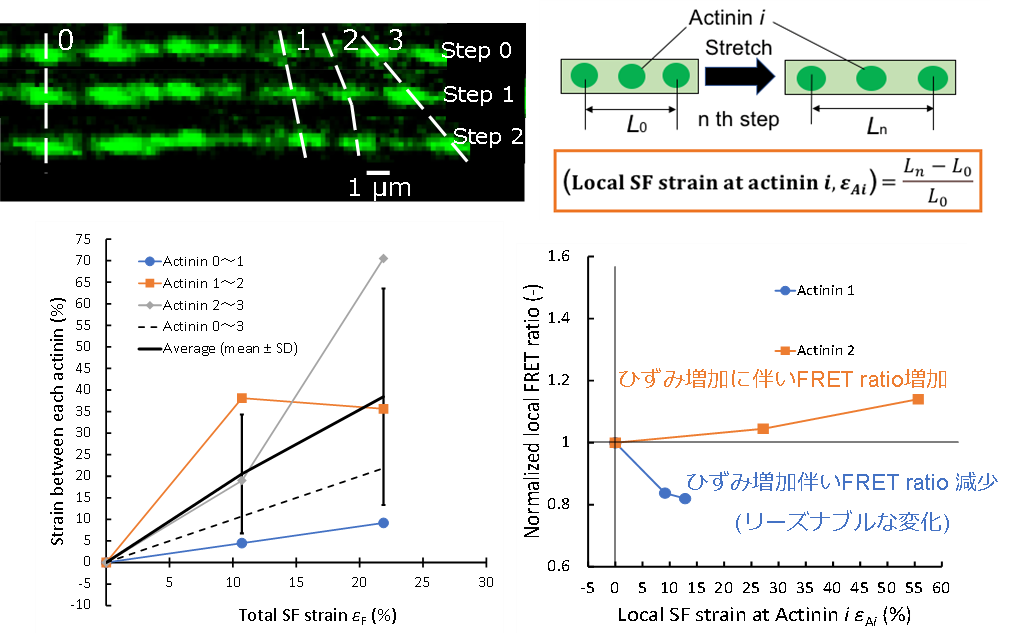
図5 アクチニン間距離変化とFRET変化(左上)引張に伴ったSF内のアクチニンの変位(右上)局所ひずみ (Local SF strain at actinin i, εAi)(左下)アクチニン間の距離変化(右下)局所ひずみに対するFRET ratioの変化
SFモデルの考案
SF内のひずみが不均質であることとFRET ratioと局所ひずみは無相関であることを説明するSFモデルを考案しました (図6).ミオシンとアクチンの結合力が場所により違うとすると,SFを引張った場合,結合が強い箇所は,ほとんど伸びずアクチニン間の距離は変化しません.一方,結合が弱い箇所は伸びが大きく,アクチニン間の距離も大きく変化します.このように両者の結合力の差がSF内のひずみの不均質性の原因かも知れません.
また,力の作用するアクチンフィラメントとアクチニンの配向角の関係によっては,赤丸の部位のように引張負荷に伴ってアクチニンが引張られる場合と青丸の部分のように圧縮される場合が考えられます.そのため,個々のアクチニンのFRET ratioと局所ひずみの相関が無かったのかも知れません.
また,力の作用するアクチンフィラメントとアクチニンの配向角の関係によっては,赤丸の部位のように引張負荷に伴ってアクチニンが引張られる場合と青丸の部分のように圧縮される場合が考えられます.そのため,個々のアクチニンのFRET ratioと局所ひずみの相関が無かったのかも知れません.
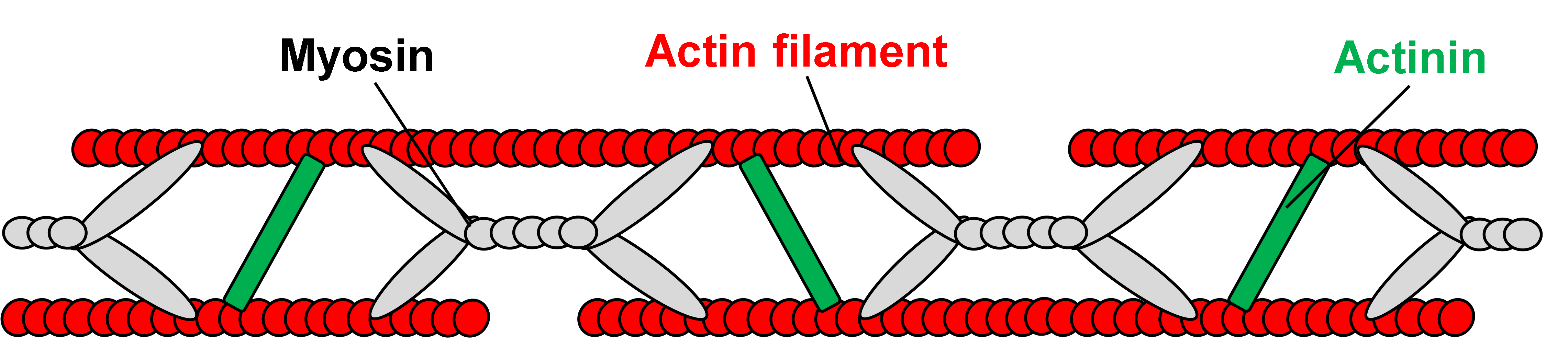
図6 SFモデル
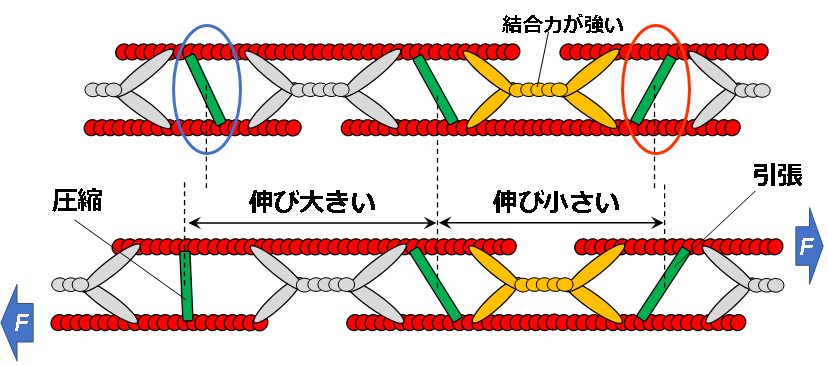
図7 SF内ひずみの不均質性,FRET ratioと局所ひずみが無相関であることの説明



